目次
- 1. 残留蛋白質量の測定の基礎知識
- 2.テストデバイスを用いた残留蛋白質量の測定
- 3.自施設で全ステップを行う場合の残留蛋白質の測定方法
- 3-1.マスター製品の選定
- 3-1-1.マスター製品を特定できない場合は全長11~18cmの止血鉗子を使用する
- 3-2.マスター製品の洗浄
- 3-2-1. マスター製品をコールドスポットに配置する
- 3-2-2. 積載は最大積載量で運転する
- 3-2-3. 熱水消毒・乾燥プログラムを行わないように洗浄器を運転する
- 3-2-4. 運転方法①:すすぎ後に運転プログラムを停止する
- 3-2-5. 運転方法②:専用の洗浄条件を設定する
- 3-3. マスター製品を自然乾燥させる
- 3-4. マスター製品の清浄性を目視で確認する
- 3-5:残留蛋白質の抽出
- 3-5-1. 1%SDS(ドデシル硫酸ナトリウム)溶液を用いて汚染物を抽出する
- 3-5-2. マスター製品に応じた抽出方法で抽出する
- 3-5-3. ポリプロピレン(PP)バッグに入れて抽出
- 3-5-4. ヒンジ/ボックスロック部分をビーカーを用いて抽出
- 3-5-5. 管腔/内腔部分からピペットやシリンジを用いて抽出
- 3-5-6. 超音波を用いて抽出
- 3-5-7. ボルテックスミキサーを用いて抽出
- 3-6. 蛋白質量の測定
- 3-6-1. 蛋白質の測定法は大きく分けて3種類ある
- 3-6-2. OPA変法
- 3-6-3. BCA法
- 3-6-4. CBB(Bradford)法
- 3-7. 残留蛋白質量の測定結果を記録・保管する
- 4. まとめ
1. 残留蛋白質量の測定の基礎知識
1-1. 洗浄のゴールは「残留蛋白質量≦200μg/RMD」を達成すること
洗浄は滅菌工程の結果を左右する重要なプロセスです。洗浄が不十分で、血液などの汚れが残留した箇所には蒸気などの滅菌剤は器材に暴露せず、滅菌することができません。
『医療現場における滅菌保証のガイドライン2021』(以下「ガイドライン」)では、洗浄後の器材に残留する蛋白質量が200μg/RMD以下であることを確認することが要求されています。
8.2 洗浄評価基準
(勧告)
洗浄後のRMDに残留する蛋白質量が、200μg/RMD以下であることを確認する出典:『医療現場における滅菌保証のガイドライン2021』p.100
1-2. 残留蛋白質量の測定が必要になるのは、洗浄条件を変更した時やPQなど
残留蛋白質量の測定が必要になるタイミングはいくつかあります。 まず挙げられるのは、洗浄条件を変更する時です。洗剤を変えたり、プログラムや積載方法を変えるなど、洗浄条件が変わる際には、その条件下で200μg/RMD以下を達成できているかを確認する必要があります。
次に、洗浄が困難な新規の器材が導入された時です。既存の洗剤やプログラムの洗浄条件で、その器材において200μg/RMD以下を達成できているかを確認します。
そして、PQ(バリデーション)を実施する時です。PQにおいては、残留蛋白質量の測定の他に、すすぎ性の確認、熱水消毒効果の確認を行い、洗浄工程全体の効果を確認します。
ガイドライン(p101)では、残留蛋白質量の測定(洗浄評価)実施のタイミングについて以下のように記載されています。
8.3.3 洗浄評価のタイミング
洗浄評価を実施するタイミングは以下とする(日常監視以外)。
1)PQをおこなう時
2)適格性の再確認をおこなう時(1年以内を目途に、1回以上実施する)
3)変更管理、例えば洗浄条件の変更、新規洗浄物の導入、修理を含む復旧や改造など、プロセスの有効性に影響する変更が生じた時出典:『医療現場における滅菌保証のガイドライン2021』p.101
1-3. 残留蛋白質量の測定は4ステップ
残留蛋白質量の測定は、①マスター製品の選定、②洗浄、③残留蛋白質の抽出、④蛋白質の定量測定の4ステップで実施します。
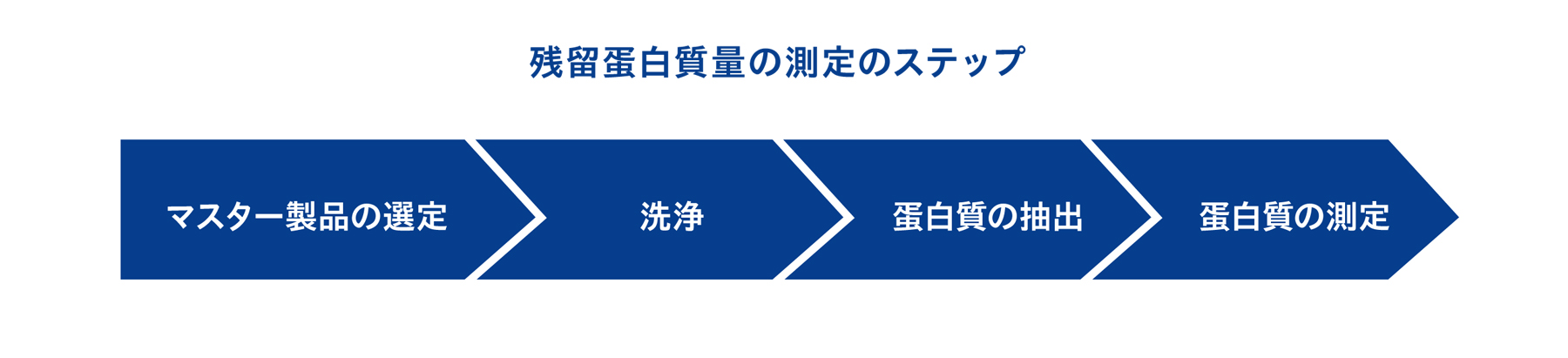
1-3-1. ステップ① マスター製品の選定
残留蛋白質量の測定を行う際に使用する器材は、器材の中で最も洗浄が難しい物を選んで行います。最も洗浄が難しい器材を「マスター製品」と呼びます。
洗浄器では、一度にたくさんの器材を洗浄します。そのすべての器材の残留蛋白質量を測定するのは、工数とコストの面から現実的ではありません。最も洗浄が難しいマスター製品において残留蛋白質量が200μg/RMD以下を達成できていれば、それよりも洗浄が容易な他の器材も達成できている、と推定できます。
具体的なマスター製品の選び方は、3-1で詳述します。マスター製品を特定できない場合は、全長11~18cmの止血鉗子をマスター製品とします。この選定方法はマスター製品が特定できない場合の暫定的な処置として、ガイドライン(p65)に記載されています。
附属書 4C マスター製品の選定方法
同一製品ファミリーにおいて、日常的に最も洗浄抵抗性が高いと考えられるマスター製品を以下の1)~3)の優先順位で選定する。
1)表4-10を参照し、RMDの構造、材質、汚染の特性を吟味し、1つ選定する。
2)1つに絞り込めない場合は、候補のRMDをすべて選定する。
3)1)および2)で特定のRMDに絞り込めない場合は、暫定的に全長11~18cmの止血鉗子を選定する。出典:『医療現場における滅菌保証のガイドライン2021』p.65
1-3-2. ステップ② 洗浄
マスター製品を実際に使用している洗浄器で洗浄します。積載量は最大積載で、マスター製品は洗浄器の中で最も洗浄しづらい位置(コールドスポット)に積載します。
この時、洗浄器にあらかじめプログラムされている熱水消毒や乾燥工程は行わないようにします。そのため、洗浄器のプログラムをすすぎ工程終了後に停止するか、もしくは熱水消毒・乾燥を行わない専用プログラムをあらかじめ設定します。
洗浄後、汚れが残っていないかマスター製品を目視確認し、清浄な室内で自然乾燥させます。
1-3-3. ステップ③ 蛋白質の抽出
1%SDS(ドデシル硫酸ナトリウム)溶液を用いて汚染物を抽出します。器材の構造の特徴によって、ビーカーを持ちいる方法や管腔部分に溶液を通す方法など、それぞれに適した抽出方法があります。具体的な抽出方法の選び方は、3-5で詳述します。
1-3-4. ステップ④ 蛋白質の測定
汚染物を抽出した液を用いて、定量法で蛋白質量を測定します。測定方法は大きく分けて3種類あり、OPA変法、BCA法、CBB法があります。このうち界面活性剤の影響を受けにくいBCA法がよく用いられます。
1-3-5. 全ステップを自施設で行うのは難しい
残留蛋白質量の測定に必要な4つのステップは、専門的な知識や設備を要することもあり、そのすべてを自施設で行うのは困難です。特に、③蛋白質の抽出④蛋白質量の測定は、研究施設が併設している大規模な病院でないと現実的には難しいと言えます。
1-4. 市販のテストデバイスやメーカーのサービスを活用するのが便利
残留蛋白質の抽出・測定は専門知識や設備が必要なため、メーカーのサービスを利用するのが便利です。各洗剤メーカーが残留蛋白質量の測定サービスを提供していることが多いです。
また、最初のステップであるマスター製品の選定においても、市販のテストデバイスを使う選択肢もあります。実際に使用している器材をマスター製品とするのが理想ですが、使用と検証のための洗浄のタイミングを合わせるのが難しかったり、数が足りなくて用意できない、といったことが起こることがあります。
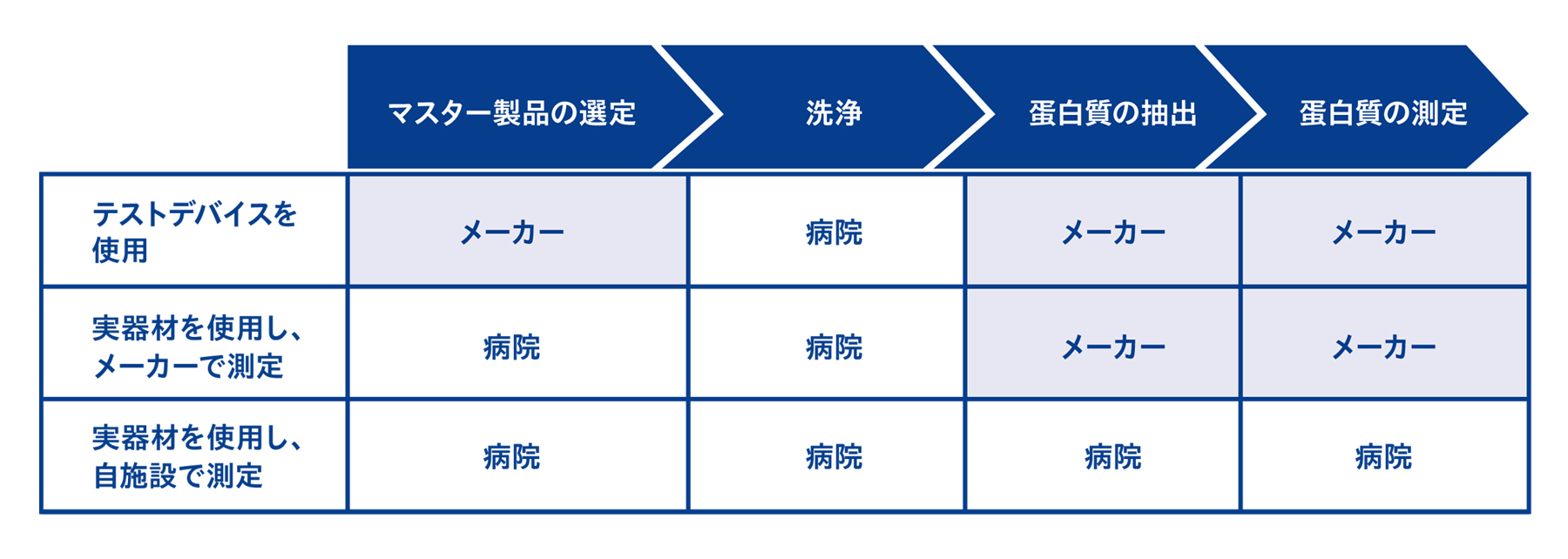 各ステップの実施者
各ステップの実施者
1-5. 設備によっては土日や平日の夜などに行う必要がある
残留蛋白質量の測定は、洗浄器の台数や稼働状況によっては、土日や平日の夜といった通常の業務時間ではない時間に行う必要があります。検証用に洗浄器を運転する際は、洗浄器の熱水消毒と乾燥プログラムを実施しないため、一緒に洗浄する他の器材も次の工程に進めません。そのため、業務時間内に検証のために洗浄器を運転するのが難しいことがあります。
2.テストデバイスを用いた残留蛋白質量の測定
2-1. テストデバイスは疑似血液を塗布した止血鉗子
テストデバイスは、ガイドラインで暫定的にマスター製品とされている「全長11~18cmの止血鉗子」に羊血などの疑似血液を塗布したものです。

開封して洗浄バスケットに展開したテストデバイス
2-2. 手順① テストデバイスを注文する
テストデバイスを購入すると、真空パックに入った状態で送られてきます。テストデバイスには使用期限があり、塗布された疑似血液の品質維持の観点から、3日間などと設定されています。そのため、検証を実施する日程をあらかじめ決めた上で注文する必要があります。
基本的にテストデバイスには取扱説明書や使い方の資料が付属していますので、それに従ってこの後の工程を実施していきます。
2-3. 手順② テストデバイスを洗浄する
2-3-1. 最大積載量で洗浄器を運転する
テストデバイスを洗浄する時は、最大積載量で運転します。これは最も洗浄が難しい状況を再現するためです。

2-3-2. テストデバイスはコールドスポットに積載する
テストデバイスを洗浄バスケットに展開し、コールドスポットに積載します。洗浄器内のどこがコールドスポットになるかは、洗浄器メーカーに確認します。
2-4. 手順③ すすぎ工程が終了したら、洗浄器を途中停止する
洗浄プログラム開始後、すすぎ工程が終了したら洗浄器の運転を途中停止します。これは、後工程で高温により蛋白質が変性してしまうのを防ぐためです。蛋白質が変性してしまうと正しい結果がでないため、熱水消毒・乾燥工程は行いません。
2-5. 手順④ テストデバイスを目視確認後、自然乾燥させる
清潔な手袋を着用して洗浄器からテストデバイスを取り出し、目視で見える小さな汚れ「残渣」(ざんさ)がないかを確認します。

洗浄器の乾燥工程をスキップしたテストデバイスは濡れているため、目視確認後、清浄な環境下で自然乾燥させます。この自然乾燥の際には、新たな蛋白質が付着せず、蛋白質が変性しないように注意します。具体的には、直射日光等高温を避ける、素手で触れない、唾や飛沫が飛ばない場所に置くようにします。
2-6. 手順⑤ テストデバイスをメーカーに返送する(後日残留蛋白質量の報告書が届く)
自然乾燥後、テストデバイスを専用のバッグに入れてメーカーに返送します。
テストデバイスの返送後、約1~2週間で洗浄評価の結果報告書が届きます。報告書には、デバイス毎の残留蛋白資量が記載されています。
すべての器材の残留蛋白質量が200μg/RMD以下であることを確認します。蛋白質量が基準値を超えている場合は、洗浄工程の改善を行います。洗浄工程の改善は、具体的には洗浄時の温度を上げたり、時間を長くする、といったことが挙げられますが、詳しくは次回の記事で解説します。
工程を変更した後は再度残留蛋白質量の測定を行い、洗浄結果が改善していることを確認します。
3.自施設で全ステップを行う場合の残留蛋白質の測定方法
3-1.マスター製品の選定
まず始めに、最も洗浄抵抗性が高い(洗浄が難しい)器材であると考えられる「マスター製品」を選定します。マスター製品は、製品ファミリー毎に選定します。
製品ファミリーとは、同じ条件で洗浄する製品群のことです。それぞれの器材の添付文書や取扱説明書に記載されている洗浄条件を参考にして、器材をいくつかの製品ファミリーに分類します。基本的に1製品ファミリーにつき、1製品をマスター製品としますが、1つに絞り切れない場合は無理に1つにする必要はなく、候補の器材をすべてマスター製品とします。
マスター製品の選び方は、それぞれの製品ファミリーにおいて、①汚染種、②汚染量、③汚染物の状態、④汚染物が残留する場所の形状・構造、⑤洗浄までに要する時間、⑥洗浄までの処理の6つの観点からチェックします。影響度「大」が多いものが「マスター製品」です。
マスター製品選定チェックリスト
| 項目 |
要因 |
影響度 |
解説 | ||
| 小 | 中 | 大 | |||
| ① | 汚染種 | 体液のみ | 血液のみ | 血液に組織・骨などが含まれる | 血液に組織、骨などが含まれるほど洗浄抵抗性が強い |
| ② | 汚染量 | 少ない | 多い |
とても多い |
汚染量が多いほど洗浄抵抗性が強い |
| ③ | 汚染物の状態 | 未変性または湿潤 | 乾燥固着 | 熱または薬剤変性 | 汚染物の状態により洗浄抵抗性が変化し、変性が最も洗浄抵抗性が強い |
| ④ | 汚染物が残留する場所の形状・構造 | 管腔内部 | 凹凸部 | 間隙部 | 汚染物が残留する場所の形状構造が複雑なほど洗浄抵抗性が強い |
| ⑤ | 洗浄までに要する時間 | 1時間未満 | 1時間~6時間以内 | 6時間以上 | この時間が長いほど洗浄抵抗性が強い |
| ⑥ | 洗浄までの処理 | プロセスケミカルズ散布や浸漬 | 湿潤処理 | なし | 洗浄までの処理がないほど、洗浄抵抗性が強い |
出典:『医療現場における滅菌保証のガイドライン2021』p.65
3-1-1.マスター製品を特定できない場合は全長11~18cmの止血鉗子を使用する
マスター製品を特定できない場合は、全長11~18cmの止血鉗子をマスター製品とします。この選定方法はマスター製品が特定できない場合の暫定的な処置として、ガイドライン(p65)に記載されています。
附属書 4C マスター製品の選定方法
同一製品ファミリーにおいて、日常的に最も洗浄抵抗性が高いと考えられるマスター製品を以下の1)~3)の優先順位で選定する。
1)表4-10を参照し、RMDの構造、材質、汚染の特性を吟味し、1つ選定する。
2)1つに絞り込めない場合は、候補のRMDをすべて選定する。
3)1)および2)で特定のRMDに絞り込めない場合は、暫定的に全長11~18cmの止血鉗子を選定する。出典:『医療現場における滅菌保証のガイドライン2021』p.65
3-2.マスター製品の洗浄
3-2-1. マスター製品をコールドスポットに配置する
マスター製品は、洗浄器内で最も洗浄されにくい「コールドスポット」に積載します。洗浄器内のどこがでコールドスポットになるかは、洗浄器メーカーに確認します。
3-2-2. 積載は最大積載量で運転する
洗浄器への積載は最大積載量で行います。これは最も洗浄が難しい状況を再現するためです。
3-2-3. 熱水消毒・乾燥プログラムを行わないように洗浄器を運転する
残留蛋白質量の測定を行う際は、洗浄器による熱水消毒および乾燥を行わないことに注意する必要があります。これは、高温になると蛋白質が熱変性してしまい、残留蛋白質量を正しく測定することができなくなってしまうためです。洗浄器による熱水消毒、乾燥を行わない方法は2つあります。
3-2-4. 運転方法①:すすぎ後に運転プログラムを停止する
1つ目は、洗浄器の運転を途中停止する方法です。普段使用している洗浄プログラムの運転を開始し、熱水消毒前のすすぎ工程が終わった段階で運転を途中停止します。
3-2-5. 運転方法②:専用の洗浄条件を設定する
2つ目は、残留蛋白質の測定専用のプログラムを新たにつくる方法です。洗浄プログラムを以下の1)~5)に従って変更します。
1)すべてのプロセスにおいて、マスター製品が60℃超に曝されないように設定および供給水温度を調整する
2)すすぎ回数を、中間と最終すすぎの合計と同じ回数に設定する
3)すすぎの最終回は、RO水を使用することが望ましい
4)防錆潤滑剤を使用しないように設定する
5)乾燥プロセスが実行されないように設定する出典:『医療現場における滅菌保証のガイドライン2021』p.66
3-3. マスター製品を自然乾燥させる
洗浄器の途中停止もしくは運転終了後、清潔な手袋を着用して洗浄器からマスター製品を取り出し、清浄な室内で自然乾燥させます。素手でマスター製品に触れてしまうと、残留蛋白質の測定結果に影響を与えてしまう可能性があるため、必ず手袋を着用します。
3-4. マスター製品の清浄性を目視で確認する
器材が乾燥した後、ライト付拡大鏡などを用いて、マスター製品を目視確認します。残渣が残っておらず、清浄性が確認されたマスター製品のみ、残留蛋白質の抽出および測定を行います。
3-5:残留蛋白質の抽出
3-5-1. 1%SDS(ドデシル硫酸ナトリウム)溶液を用いて汚染物を抽出する
清浄性を目視確認したマスター製品から、1%SDS溶液を用いて汚染物を抽出します。SDS溶液とは、ドデシル硫酸ナトリウム(Sodium Dodecyl Sulfate)を水に溶解させた溶液のことで、蛋白質に対して極めて高い親和性を持ち、蛋白質を可溶化できるため抽出に用いられます。
3-5-2. マスター製品に応じた抽出方法で抽出する
各マスター製品それぞれの特性にあった抽出方法で汚染物を抽出します。以下の基準を元に、そのマスター製品がどの洗浄評価分類になるかを判断します。
洗浄評価分類1:分解可能なヒンジ/ボックスロック部、穴や凹み/内腔を有しないRMD
洗浄評価分類2:分解可能なヒンジ/ボックスロック部を有するRMD
洗浄評価分類3:超音波を使用しない/できないスライドシャフトを有するRMD
洗浄評価分類4:分解可能な管腔/内腔を有するRMD
洗浄評価分類5:超音波を使用しない/できないマイクロサージャリー用RMD
洗浄評価分類6:複合素材で構成されたRMD(ロボット支援手術機器)のシャフト部分
洗浄評価分類7:超音波が可能なフレキシブル部を有するRMD
抽出作業にあたっては、マスター製品や抽出・測定に使用する機器への再汚染を避けるため、手袋を装着して実施します。
3-5-3. ポリプロピレン(PP)バッグに入れて抽出
マスター製品が入る大きさの丈夫なPPバッグに、2~5mLの1%SDS溶液とマスター製品を入れて残留汚染物を抽出します。
特に汚染されているマスター製品の可動部などは、PPバッグの表面を介してもみ洗いを行い念入りに汚染物を剥離させます。また、PPバッグ全体を傾け、凹みや内部にSDS溶液を接触させて、汚染物を抽出します。
<適用される分類例>
洗浄評価分類1:分解可能なヒンジ/ボックスロック部、穴や凹み/内腔を有しないRMD
洗浄評価分類2:分解可能なヒンジ/ボックスロック部を有するRMD
洗浄評価分類3:超音波を使用しない/できないスライドシャフトを有するRMD
洗浄評価分類5:超音波を使用しない/できないマイクロサージャリー用RMD
洗浄評価分類7:超音波が可能なフレキシブル部を有するRMD
3-5-4. ヒンジ/ボックスロック部分をビーカーを用いて抽出
50mLビーカーを準備し、ヒンジ/ボックスロック部にピペットを用いて1%SDS溶液を2~5mL滴下します。ビーカーを斜めにし、ヒンジ/ボックスロック部が浸漬するまで傾けます。ヒンジ/ボックスロック部をできるだけ大きく5回開閉します。そして、ビーカーの側面に沿わせながらマスター製品を左右に数十回振って攪拌(かくはん)し、ヒンジ/ボックスロック部を開いてビーカーの縁に掛け10分間静置します。このプロセスをさらに2回実施します。
<適用される分類例>
洗浄評価分類2:分解可能なヒンジ/ボックスロック部を有するRMD
3-5-5. 管腔/内腔部分からピペットやシリンジを用いて抽出
管腔/内腔を有するマスター製品を、シャフト部分の先端/末端部をビーカーの底に触れないように入れて固定します。
ピペットやシリンジを用いて、2~6mLの1%SDS溶液をシャフト内部に通します。その後、10分間の浸漬静置をします。溶液を回収し、この回収した溶液を使って同じ手順を3~5回繰り返します。
<適用される分類例>
洗浄評価分類4:分解可能な管腔/内腔を有するRMD
洗浄評価分類6:複合素材で構成されたRMD(ロボット支援手術機器)のシャフト部分
3-5-6. 超音波を用いて抽出
ガラス製の試験管に、マスター製品の可動部が浸漬するまでの少量の1%SDS溶液を入れ、超音波を用いて抽出します。分解が不可能で間隙(かんげき)領域を有するマスター製品に使用できますが、超音波が使用可能なマスター製品に限られます。抽出の際、手動で可動部を動作させます。
<適用される分類例>
洗浄評価分類3:超音波が可能なスライドシャフトを有するRMD
洗浄評価分類7:超音波が可能なフレキシブル部を有するRMD
3-5-7. ボルテックスミキサーを用いて抽出
複雑な形状のマスター製品の抽出は、2~4mLの1%SDS溶液を用いてボルテックスミキサー装置を使用し、試験管内で抽出します。ロボット支援手術機器の先端機能部などの場合は、5~10分ごとに15秒間振動を加えて行います。
<適用される分類例>
洗浄評価分類5:超音波を使用しない/できないマイクロサージャリー用RMD
洗浄評価分類6:複合素材で構成されたRMD(ロボット支援手術機器)のシャフト部分
3-6. 蛋白質量の測定
3-6-1. 蛋白質の測定法は大きく分けて3種類ある
抽出した残留汚染物を用いて、定量法で蛋白質量を測定します。定量法には大きく3種類あります。
3-6-2. OPA変法
OPA法は、試薬のo-フタルアルデヒド(OPA)がタンパク質と反応する際に生じる蛍光を測定することで、タンパク質の量を定量する方法です。非常に感度が高く、迅速に測定できる点が特徴です。
ただし、多くの場合、測定前にタンパク質を分解するなどの前処理が必要となることがあります。
3-6-3. BCA法
BCA法は、アルカリ性の条件下で、タンパク質と試薬中の銅イオン、そしてビシンコニン酸(BCA)が反応して生成する紫色の物質の濃度を、吸光度を測定することによって決定し、タンパク質濃度を定量する方法です。タンパク質定量法として広く用いられています。
比較的感度が高く、タンパク質定量でしばしば問題となる界面活性剤の影響を受けにくいという利点があります。
3-6-4. CBB(Bradford)法
CBB法(Bradford法)は、酸性の条件下で、タンパク質が色素であるクマシーブリリアントブルー(CBB)と結合することを利用した方法です。この結合により色素の色が赤褐色から青色に変化するため、その青色の濃さ(吸光度)を測定することでタンパク質の量を定量します。
操作が簡便で、数分で結果が得られる迅速さが大きな特長ですが、界面活性剤(特にSDSなど)が存在すると正確な測定が難しくなる場合があります。
3-7. 残留蛋白質量の測定結果を記録・保管する
数値による結果と積載条件などを記録し、保管します。積載条件は文章で記載するよりも、カメラなどで撮影して画像で記録した方がわかりやすいです。
参考に、ガイドライン(p102)には、洗浄評価の結果記録の一例が示されています。
表8-1 PQおよび適格性再確認におけるRMDの洗浄評価結果一覧(例)
| 番号 |
RMD名称 |
洗浄評価分類 | 配置位置 | 目視確認 | RMDの推定表面積(cm²) | 残留蛋白質量(μg/RMD) | 洗浄評価分類目標値(μg/RMD) | 結果 |
出典:『医療現場における滅菌保証のガイドライン2021』p.102
すべての器材の残留蛋白質量が200μg/RMD以下であることを確認します。
蛋白質量が基準値を超えている場合は、洗浄工程の改善を行います。工程を変更した後は再度残留蛋白質量の測定を行い、洗浄結果が改善していることを確認します。
4. まとめ
いかがでしたでしょうか。
適切な洗浄の基準値は「残留蛋白質量が200μg/RMD以下であること」であり、器材が適切に洗えているかを検証するために実施するのが、残留蛋白質量の測定です。
残留蛋白質量の測定は、①マスター製品の選定、②洗浄、③残留蛋白質の抽出、④蛋白質の定量測定の4ステップで実施します。③・④は専門的な知識や設備が必要になるため、メーカーが提供するサービスを利用するのが現実的です。①が難しい場合は、暫定的に市販のテストデバイスを利用することもできます。②は自施設で実施に使用している洗浄器を用いて行いますが、洗浄器による熱水消毒および乾燥工程を行わないように運転する必要があります。
残留蛋白質量の測定を行った結果、200μg/RMD以下を達成していない場合は、洗浄工程の改善を行います。
本記事の内容に関するお問合せは、営業担当またはSALWAYウェブサイトのお問合せフォームよりご連絡下さい。








