目次
- 1. 洗浄工程の重要性
- 2. 洗浄評価の考え方
- 3. 洗浄工程のバリデーションの流れ
- 4. 洗浄器のバリデーション(PQ)の実施方法
- 4-1. PQの実施手順は9ステップ
- 4-2. ①製品ファミリーの分類:同じ条件で洗浄する製品群に分ける
- 4-3. ②マスター製品の選定:製品ファミリーの中で最も洗浄しづらい製品を特定する
- 4-3-1. マスター製品を特定できない場合は、暫定的に「全長11~18cmの止血鉗子」を選定する
- 4-4. ③積載方法の設定:WDへ器材を積載する時のルールを決める
- 4-4-1. 積載方法を設定する
- 4-4-2. 最大積載量を設定する
- 4-5. ④洗浄消毒条件の設定:製品ファミリーに適応可能な洗浄・消毒条件を設定する
- 4-6. ⑤マスター製品の洗浄評価:マスター製品が適切に洗浄できているかを確認する
- 4-6-1. 残留蛋白質量を測定する
- 4-6-2. すすぎ性を確認する
- 4-7. ⑥熱水消毒効果の確認:規定された消毒基準(温度・時間)に到達しているか確認する
- 4-8. ⑦乾燥性能と製品適格性を確認する
- 4-8-1. 乾燥性能の確認:器材が適切に乾燥しているかを確認する
- 4-8-2. 製品適格性の確認:器材の安全性、品質、性能を確認する
- 4-9. ⑧バリデーション報告書の作成:バリデーションに使用したRMDや試験結果を記録する
- 4-10. ⑨SOPの作成:日常の再生処理に用いる標準作業手順書(SOP)を作成する
- 4-11. バリデーション(PQ)のまとめ
- 5. 洗浄工程の日常モニタリング
- 6. まとめ
1. 洗浄工程の重要性
1-1. 洗浄は滅菌の可否を左右する重要なプロセス
滅菌器による菌の殺滅は、適切な洗浄があって初めて成立します。「洗浄なくして滅菌なし」という言葉がある通り、洗浄は医療器材の再生処理において、とても重要なプロセスです。
洗浄工程が重要な理由は、大きく3つあります。1つめの理由は、洗浄工程は「バイオバーデン(初発菌数)」を大きく減らす役割を担っていること。2つめは、汚れが残留した箇所は、滅菌剤が暴露しないこと。そして3つ目は、洗浄工程が不適切であると「パイロジェン」と呼ばれる発熱物質の発生につながることです。
次項より、この3点について詳しく見ていきます。
1-2. ①洗浄工程はバイオバーデンを減らす
1つは、バイオバーデン(初発菌数)の問題です。バイオバーデンとは、再生処理(洗浄や滅菌)を行う前に器材に付着している菌数を指します。
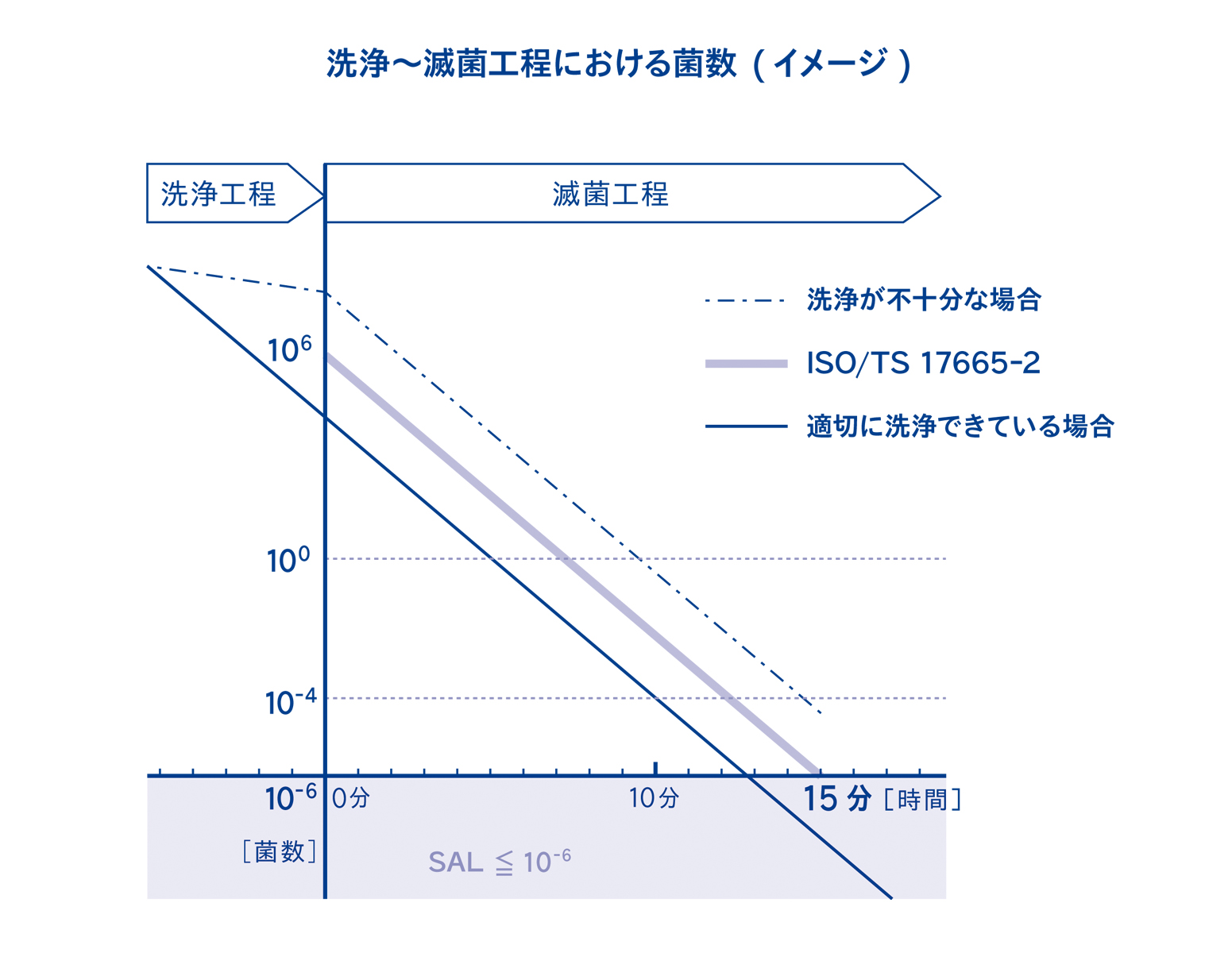
国際規格ISO/TS 17665-2には、蒸気滅菌の滅菌温度に対する保持時間の条件が示されています。この蒸気滅菌条件は、10⁶個(100万個)の菌を滅菌することを前提としています。例えば、10⁶個の菌を滅菌するためには、121℃の蒸気の場合、15分必要ということを意味しています。
蒸気滅菌条件(ISO/TS 17665-2)
| 滅菌温度 | 保持時間 |
| 121℃ | 15分 |
| 126℃ | 10分 |
| 134℃ | 3分 |
洗浄が適切に行われた場合は、バイオバーデンが10⁶個を下回るため、121℃ 15分の滅菌で余裕をもってSAL≦10⁻⁶を達成することができます。一方洗浄が不十分で、バイオバーデンが10⁶個を上回ってしまった場合、121℃ 15分で滅菌しても、SAL≦10⁻⁶を達成できない=滅菌不良となってしまう可能性があります。
1-3. ②汚れが残留した箇所は滅菌剤が暴露しない
2つ目は、滅菌剤の暴露の問題です。
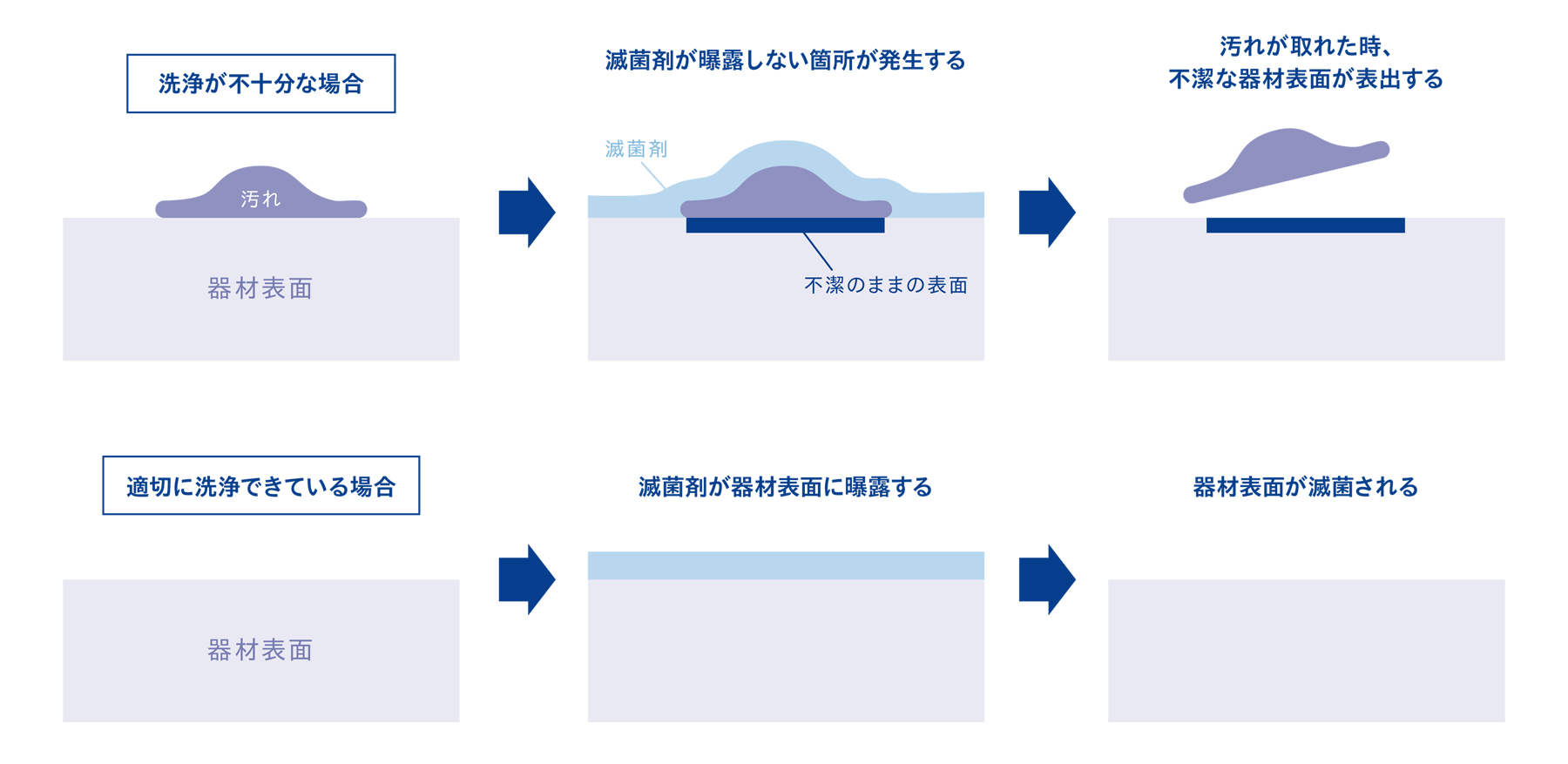
例えば高圧蒸気滅菌であれば、滅菌剤である蒸気を器材に暴露させることにより菌を殺滅します。しかし、血液などの汚れが付着した状態では、蒸気は器材に暴露せず滅菌することができません。
仮に器材の使用中にこの汚れが取れた場合、滅菌されていない不潔な状態の器材表面が表出することになります。
1-4. ③不適切な洗浄はパイロジェンの発生にも繋がる
最後は、パイロジェン(発熱物質)の問題です。パイロジェンとは微生物の死骸です。
血液などのが汚れが付着した状態で滅菌を行うと、パイロジェンが器材に残ってしまいます。パイロジェンは、血流に混入した場合、発熱の原因になることがあります。また微生物によっては、死滅時に有毒物質を排出するものも存在し、それらが重篤な病気の原因になることもあります。
2. 洗浄評価の考え方
2-1. 洗浄評価の基準値は「残留蛋白質量≦200μg/RMD」
その器材(RMD)が適切に洗浄できているかの基準は、『医療現場における滅菌保証のガイドライン2021』(以下『ガイドライン』)に記載されています。ガイドライン(p100)では、洗浄後のRMDに残留する蛋白質量が200μg/RMD以下であることを確認することが要求されています。
8.2 洗浄評価基準
(勧告)
洗浄後のRMDに残留する蛋白質量が、200μg/RMD以下であることを確認する
2-2. 毎回全ての器材の残留蛋白質量の測定を行うことはできない
すべての器材の洗浄を評価するには、洗浄後に全ての器材から蛋白質を抽出し測定する必要があります。しかし、洗浄器では一度にたくさん器材を洗浄しますし、そもそも蛋白質を抽出するための薬剤が器材に付着したら再度洗浄しなくてはなりません。
つまり、毎回すべての器材の蛋白質量を測定することは現実的ではありません。では、どのようにすべての器材の洗浄を評価するのでしょうか。ここで2つの考え方が登場します。
2-3. 洗浄評価はワーストケースで考える
洗浄評価では、最も洗浄が難しい器材が洗浄できていれば、それよりも洗浄が容易な他の器材は洗浄できていると推定します。これがワーストケースの考え方です。
具体的には、まず同一条件で洗浄可能な製品を集めて「製品ファミリー」を設定します。その製品ファミリーの中で最も洗浄が難しい器材を「マスター製品」として選定し、そのマスター製品が洗浄できているかを確認します。
2-4. 洗浄工程は「バリデーション+日常モニタリング」で評価する
洗浄後に器材に残留した蛋白質量を計測する際には薬剤を使用するため、薬剤を使用した器材は再度洗浄する必要があります。また蛋白質の抽出には、時間とコストもかかるため、毎回実施するのは現実的ではありません。
そこで、最も洗浄が難しいマスター製品を洗浄できるプログラムになっているかを検証し(バリデーション)、そのプログラムが正しく繰り返されているかを毎回確認する(日常モニタリング)ことで、洗浄工程を評価します。このように「バリデーション+日常モニタリング」によって洗浄工程を評価することが、洗浄評価の基本的な考え方です。
次の章から、バリデーションと日常モニタリングの基本について解説します。
3. 洗浄工程のバリデーションの流れ
3-1. バリデーションはIQ、OQ、PQで構成される
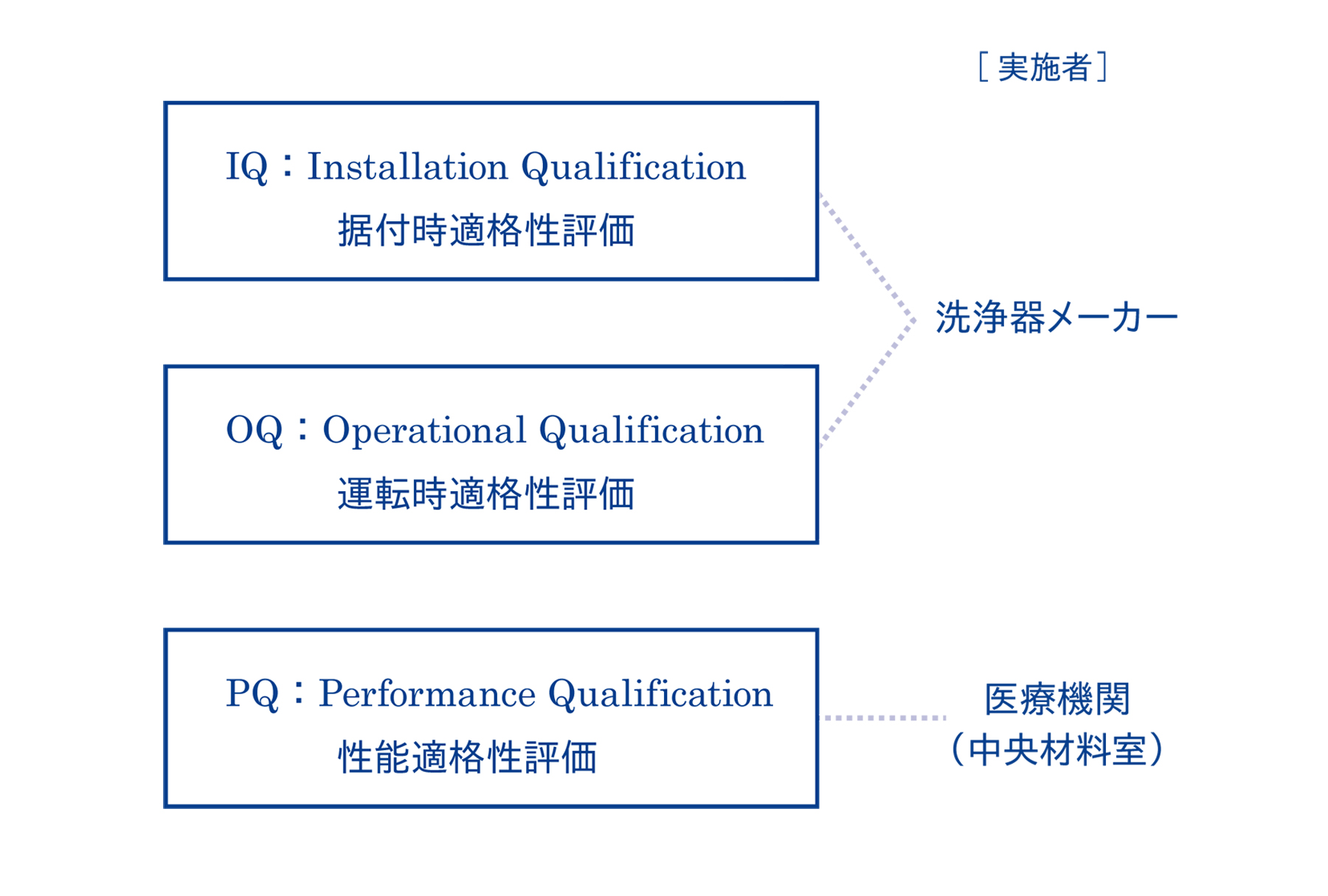
ウォッシャー・ディスインフェクター(WD)などの洗浄器のバリデーションは3ステップで、IQ(据付時適格性評価)、OQ(運転時適格性評価)、PQ(性能適格性評価)の順番で実施します。
3-2. バリデーションの前提にはキャリブレーションがある
バリデーションを実施したとしても、WDの温度計やデータロガーが示す数値が正しくなければ意味がありません(温度計は55℃と示しているが実際の温度は53℃など)。バリデーションでは、使用する計器が適切にキャリブレーション(校正)されていることが前提となります。
3-3. IQでは洗浄器の設置が正しく行われたかを確認する
WDのIQでは、洗浄器の設置時に電気、各種配管接続、付属ゲージ、ストレーナおよびユーティリティーなどを検査します。洗浄器が正しく設置されているかを確認します。
3-4. OQでは洗浄器が正常に運転できる状態かを確認する
WDのOQでは、温度や圧力センターの正確性の確認や、洗剤の投入システム、扉のインターロック、漏水、スプレーアームの回転やノズルの目詰まりなどを検査します。あわせて、コールドスポット(槽内で最も温度が上がりにくい場所)も特定します。
3-5. PQでは洗浄した器材が適切に洗浄されているかを確認する
PQでは、最も洗浄が難しいマスター製品を選定し、その洗浄評価を実施します。洗浄評価では、残留蛋白質量の測定やすすぎ性について確認をします。また、洗浄後の熱水消毒工程が消毒基準に達しているか、洗浄後の器材の適格性が確保できているかも確認します。
PQの具体的な方法は、4章で詳しく解説します。
3-6. IQとOQは洗浄器メーカーが実施する
IQ・OQは、洗浄器メーカーでないと検証できない範囲のため、洗浄器メーカーが実施します。洗浄器メーカーからIQおよびOQの報告書をもらい、その結果を記録しておきます。
IQは据え付け時にのみ行いますが、定期点検ではOQの一部の検証の他、バリデーションの要である温度計や圧力計のキャリブレーションも実施してもらえるので、洗浄器メーカーに相談してみるのもおすすめです。
3-7. PQは医療機関(中央材料室)が実施する
医療機関ごとに、使用する器材や洗浄前の保管条件、洗浄器への積載条件は異なります。そのため、PQは医療機関(中央材料室)が実施する必要があります。PQを実施する主体は医療機関(中央材料室)ですが、洗浄器の設定も関わってくるため洗浄器メーカーが協力してくれることもあります。
4. 洗浄器のバリデーション(PQ)の実施方法
4-1. PQの実施手順は9ステップ
医療機関が実施するPQでは、製品ファミリーの分類を行った上で、もっとも洗浄が困難なマスター製品を選定し、そのマスター製品が適切に洗浄されているかを評価します。
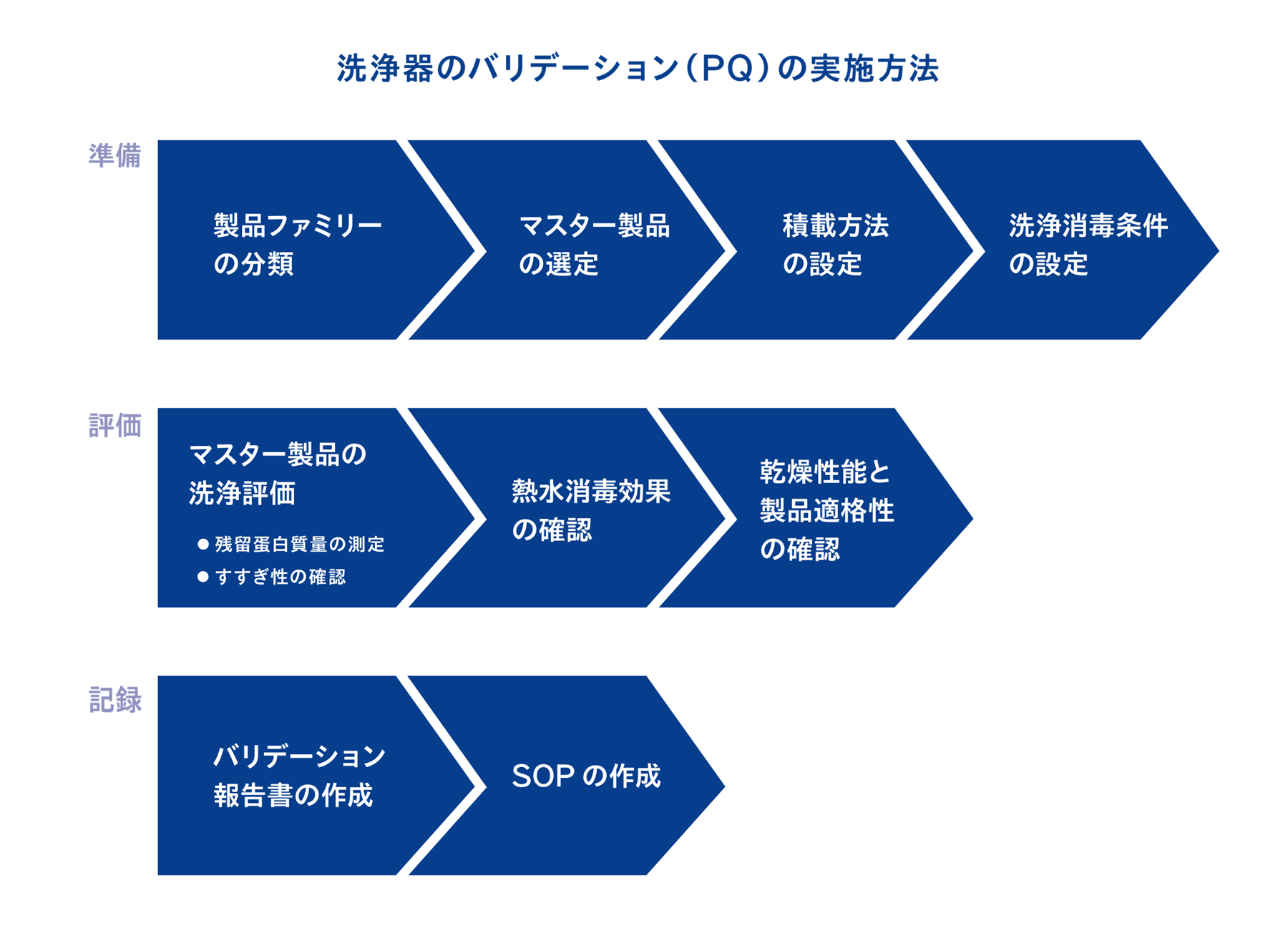
4-2. ①製品ファミリーの分類:同じ条件で洗浄する製品群に分ける
各器材の添付文書や取扱説明書に記載されている洗浄条件を参考に、同じ条件で洗浄する製品群(製品ファミリー)に分類します。
例えば、ある器材の添付文書に「強アルカリ洗剤は、器具を腐食させる恐れがあるので使用を避けること」と記載があった場合、同じ洗浄条件(酵素洗剤を使用したプログラム)で洗浄する器材と同じ製品ファミリーとします。
4-3. ②マスター製品の選定:製品ファミリーの中で最も洗浄しづらい製品を特定する
マスター製品の選定は、①汚染種、②汚染量、③汚染物の状態、④汚染物が残留する場所の形状・構造、⑤洗浄までに要する時間、⑥洗浄までの処理の6つの観点からチェックします。影響度「大」が多いものを、マスター製品として選定します。
マスター製品選定チェックリスト
| 項目 |
要因 |
影響度 |
解説 | ||
| 小 | 中 | 大 | |||
| ① | 汚染種 | 体液のみ | 血液のみ | 血液に組織・骨などが含まれる | 血液に組織、骨などが含まれるほど洗浄抵抗性が強い |
| ② | 汚染量 | 少ない | 多い |
とても多い |
汚染量が多いほど洗浄抵抗性が強い |
| ③ | 汚染物の状態 | 未変性または湿潤 | 乾燥固着 | 熱または薬剤変性 | 汚染物の状態により洗浄抵抗性が変化し、変性が最も洗浄抵抗性が強い |
| ④ | 汚染物が残留する場所の形状・構造 | 管腔内部 | 凹凸部 | 間隙部 | 汚染物が残留する場所の形状構造が複雑なほど洗浄抵抗性が強い |
| ⑤ | 洗浄までに要する時間 | 1時間未満 | 1時間~6時間以内 | 6時間以上 | この時間が長いほど洗浄抵抗性が強い |
| ⑥ | 洗浄までの処理 | プロセスケミカルズ散布や浸漬 | 湿潤処理 | なし | 洗浄までの処理がないほど、洗浄抵抗性が強い |
出典:『医療現場における滅菌保証のガイドライン2021』p.65
4-3-1. マスター製品を特定できない場合は、暫定的に「全長11~18cmの止血鉗子」を選定する
マスター製品を特定できない場合は、全長11~18cmの止血鉗子をマスター製品として選定します。この方法は、マスター製品が特定できない場合の暫定的な処置としてガイドライン(p65)に記載されています。
附属書 4C マスター製品の選定方法
同一製品ファミリーにおいて、日常的に最も洗浄抵抗性が高いと考えられるマスター製品を以下の1)~3)の優先順位で選定する。
1)表4-10を参照し、RMDの構造、材質、汚染の特性を吟味し、1つ選定する。
2)1つに絞り込めない場合は、候補のRMDをすべて選定する。
3)1)および2)で特定のRMDに絞り込めない場合は、暫定的に全長11~18cmの止血鉗子を選定する。
4-4. ③積載方法の設定:WDへ器材を積載する時のルールを決める
WDへの器材の積載ルールの設定にあたっては、①積載方法と②最大積載量の2点を考える必要があります。
4-4-1. 積載方法を設定する
WDへのRMDの積載方法を、WDの取扱説明書や器材メーカーからの情報をもとに設定します。器材を確実に洗浄し、かつその適格性(安全性、品質、性能)を守るために、以下の点に留意します。
・RMDメーカーが指定する方法に基づいて、可能な限りWD適用前に分解する
・ヒンジ部など、開放できる箇所は事前に開放する
・マイクロ手術器械は、水流、揺動による破損を防止できる対策を講じる(専用のバスケットの使用など)
・内腔を有する器具に対し、管内部への灌流が可能な対策を講じる(送水ポートへの接続など)
・ビーカー、カップ、膿盆、シャーレは、開口部および内部に水流が届くように積載する
4-4-2. 最大積載量を設定する
器材の洗浄性やすすぎ性に影響を与える最大積載量を、WDの取扱説明書や各種文献を参考に設定します。また、洗浄槽内での洗浄バスケットの配置場所や1段あたりの許容積載数、内腔を有する器材に使用される専用アクセサリー(洗浄ポートなど)の装着位置についても設定します。
参考になる文献として、以下の資料があります。
『滅菌管理部門スタッフのための教育ツール』医療現場の洗浄と滅菌業務 洗浄Ⅱ(第1版)
4-5. ④洗浄消毒条件の設定:製品ファミリーに適応可能な洗浄・消毒条件を設定する
製品ファミリーに対して適応可能な洗浄条件・熱水消毒条件を、WDメーカーに確認して設定します。一般的な洗浄消毒条件は以下の通りです。
一般的な洗浄消毒条件の設定
| 工程 |
中温洗浄 | 高温洗浄 | ||||
| 時間(分) | 温度(℃) | プロセスケミカルズ | 時間(分) | 温度(℃) | プロセスケミカルズ | |
| 予備洗浄 | 1~3 | ― | ― | 1~3 | ― | ― |
| 本洗浄 | 5~15 | 40~60 |
アルカリ性洗剤 |
5~15 |
60~90 |
アルカリ性洗剤 |
| 中間すすぎ※1 | 1~2 | ― | 中和剤(適宜) | 1~2 | ― | 中和剤(適宜) |
| 最終すすぎ※2 | 5~10 | ― | 最終添加剤(適宜) | 5~10 | ― | 防錆潤滑剤(適宜) |
| 乾燥 | 10~30 | 80~110 | 126℃ | 10~30 | 80~110 | ― |
※1 洗剤メーカが指定する許容値以下まで洗剤の残留量を減少できる条件を確認する
※2 通常、熱水消毒を兼ねるが、乾燥効果促進のため予熱を意図する場合がある
出典:『医療現場における滅菌保証のガイドライン2021』p.57
洗浄インジケータを使用する場合は、インジケータの判定方法や配置場所などを、洗浄インジケータの取説に基づいて設定します。
4-6. ⑤マスター製品の洗浄評価:マスター製品が適切に洗浄できているかを確認する
マスター製品をWDに積載し、運転を開始します。洗浄器のプログラムを以下のように設定します。
【洗浄評価時のプログラム設定】
・最大積載量となるように洗浄槽に積載する
・マスター製品を洗浄槽のコールドスポットに配置する
・マスター製品が60℃超に曝されないように設定する
・すすぎの回数を、前項「4-5.」で設定した中間と最終すすぎの合計と同じ回数に設定する
・すすぎの最終回はRO水を使用することが望ましい
・防錆潤滑剤を使用しないように設定する
・乾燥プロセスが実行されないように設定する
洗浄終了後、マスター製品を取り出し、適切に洗浄できているかを確認します。①残留蛋白質量、②すすぎ性の2点で評価を行います。
4-6-1. 残留蛋白質量を測定する
マスター製品が確実に洗浄されていることを確認します。洗浄終了後、マスター製品を清浄な室内で乾燥させたのち、残留蛋白質を抽出し測定します。マスター製品の残留蛋白質量が200μg以下であることを確認します。残留蛋白質の測定キットは市販されており、キットを使用して抽出したものを検査センターを送ることで、結果が送られてきます。
4-6-2. すすぎ性を確認する
マスター製品から洗剤が確実に除去されていることを確認します。マスター製品をすすいだ後の水とすすぎに使用した水を採取し、洗剤メーカーへすすぎ性能試験を依頼します。すすぎ性能試験は医療現場で実施することが技術的に困難なので、通常洗剤メーカーに依頼します。
すすぎ性能試験実施例
| 対象 | 操作 ※1 | 測定項目例 ※2 | 合否判定基準 |
| 用手洗浄 | すすぎに用いた水とすすぎ後の水を採取する | pH、導電率、泡立ち、洗剤成分など | プロセスケミカルズメーカが設定した基準を満たすこと |
| 機械洗浄 | すすぎ工程に供給された水とすすぎ工程後の排水を採取する | pH、導電率、洗剤成分など |
※1 具体的な採取操作・量・条件については、予めプロセスケミカルズメーカに確認する
※2 測定項目は、プロセスケミカルズメーカが定める
出典:『医療現場における滅菌保証のガイドライン2021』p.102
4-7. ⑥熱水消毒効果の確認:規定された消毒基準(温度・時間)に到達しているか確認する
熱水消毒効果の確認は、防錆潤滑剤の使用もしくは乾燥プロセスを含んだ通常のプロセスで実施します。
温度上昇が最も遅いコールドスポットにおいて、設定された温度と時間、または規定された熱水消毒基準に必要なA₀値以上が達成されたことを確認します。マスター製品に外部温度センサー(データロガー)を取り付け、熱水洗浄工程中の温度および時間を記録し確認します。
外部温度センサーは高額なため、購入が難しい場合は洗浄器メーカーから借りるなどして手配します。
4-8. ⑦乾燥性能と製品適格性を確認する
洗浄消毒プロセスを経た後の器材の状態を確認して、洗浄器の乾燥性能と製品適格性を確認します。
4-8-1. 乾燥性能の確認:器材が適切に乾燥しているかを確認する
運転終了後、洗浄槽から器材を取り出し、撥水性の不織布の上に置きます。器材を振ったり、エアを吹き付けることでRMDの残水を不織布に落とし、その水分量から合否判定します。合否基準は、各医療機関で設定します。
4-8-2. 製品適格性の確認:器材の安全性、品質、性能を確認する
洗浄および消毒をした器材が、問題なく使用できる状態であるか、その安全性や品質、性能を確認します。具体的には、下記のような項目をチェックします。
洗浄後のRMDの製品適格性確認項目
|
k項目 |
確認事項 |
| 安全性 | すすぎ性、リークテスト、亀裂の有無、欠損の有無など |
| 品質 | 触感、軋み音(その他の異音を含む)、動作、変形の有無 |
| 性能 | 切れ味、把持力(感)、ラッチ、摺動部などの正常性 |
出典:『医療現場における滅菌保証のガイドライン2021』p.60
4-9. ⑧バリデーション報告書の作成:バリデーションに使用したRMDや試験結果を記録する
バリデーション報告書に、使用したRMDや積載状態、洗浄プロセスの試験結果について記録し、洗浄責任者の審査と承認を得ます。
4-10. ⑨SOPの作成:日常の再生処理に用いる標準作業手順書(SOP)を作成する
承認されたバリデーション報告書に基づき、日常の再生処理に用いる標準作業手順書(SOP)を作成して、洗浄責任者の承認を得ます。
4-11. バリデーション(PQ)のまとめ
| ステップ | 概要 |
| ①製品ファミリーの分類 | 各器材の添付文書や取説に記載されている洗浄条件を参考に、同じ条件で洗浄する製品ファミリーに分類する |
| ②マスター製品の選定 | 製品ファミリーの中で、もっとも洗浄が難しいRMDをマスター製品として選定する。特定のRMDに絞り込めない場合は、暫定的に「全長11~18cmの止血鉗子」を選定する |
| ③積載方法の設定 | WDへのRMDの積載方法を、WDの取説や器材メーカーからの情報をもとに設定する。また、RMDの洗浄性やすすぎ性に影響を与える最大積載量をWDの取説や文献を参考に設定する |
| ④洗浄消毒条件の設定 | 製品ファミリーに対して適応可能な洗浄条件・熱水消毒条件を、WDメーカーに確認して設定する |
| ⑤マスター製品の洗浄評価 | 【残留蛋白質量】マスター製品の残留蛋白質量を測定し、≦200μg/RMDであることを確認する 【すすぎ性】マスター製品から洗剤が確実に除去されていることを確認する |
| ⑥熱水消毒効果の確認 | 温度上昇がもっとも遅いコールドスポットにおいて、規定の温度と時間(またはA₀値)に到達していることを確認する |
| ⑦製品適格性および乾燥性能の確認 | 洗浄および消毒した後のRMDの安全性や品質、性能を確認する。合わせて、RMDが適切に乾燥しているかを確認する |
| ⑧バリデーション報告書の作成 | バリデーションに使用したRMDや積載状態、洗浄プロセスの試験結果について記録する |
| ⑨SOPの作成 | バリデーション報告書に基づき、日常の再生処理に用いる標準作業手順書(SOP)を作成する |
5. 洗浄工程の日常モニタリング
5-1. バリデートしたプロセスが繰り返されているかを日常的に確認する
もっとも洗浄が難しいマスター製品が洗浄できるプロセスであるかをバリデーション(PQ)で検証したら、その検証されたプロセスが繰り返されているかを日常的に確認します。これを日常モニタリングといいます。
日常モニタリングは、積載条件、スプレーアーム、運転記録、洗浄インジケータ、RMDの目視確認の5つの項目でチェックを行い、データを記録・保管します。
| 項目 |
タイミング | |
| 運転開始時 | 運転開始後 | |
| 積載形態 | ✔ | ✔ |
| スプレーアームの回転障害の有無 | ✔ | ✔ |
| 運転記録 | ― | ✔ |
| 洗浄インジケータ | ― | ✔ |
| RMDの目視確認 | ― | ✔ |
5-2. 積載形態:適切に積載されているかを確認する
4-4.で設定したRMDの積載方法が守られているか、最大積載量以下に収まっているかを、WDへの積載時および運転終了後に確認します。
5-3. スプレーアームの回転障害の有無:スプレーアームが適切に回転するかを確認する
WDへラックを搬入する際、スプレーアームが適切に回転するかを確認します。また運転終了後も、スプレーアームがきちんと回る状態であったかを再度確認します。これは、WDの運転中に水流によってRMDが動いてしまい、その器材に引っかかってアームが回らなくなってしまうこともあるためです。
5-4. 運転記録:温度や時間、洗剤投入量などが適切かを確認する
洗浄効果に影響を与えるプロセス変数がバリデーションで設定した条件を満たしているかを確認します。確認が必要なプロセス変数は以下の通りです。
・洗浄温度と時間
・プロセスケミカルズの投入量/または濃度
・熱水消毒時温度と時間
確認は基本的に運転ごとに実施しますが、WDに運転監視機能がついていない場合は、最低1日1回確認します。
5-5. 洗浄インジケータ:洗浄インジケータが合格基準を満たしているかを確認する
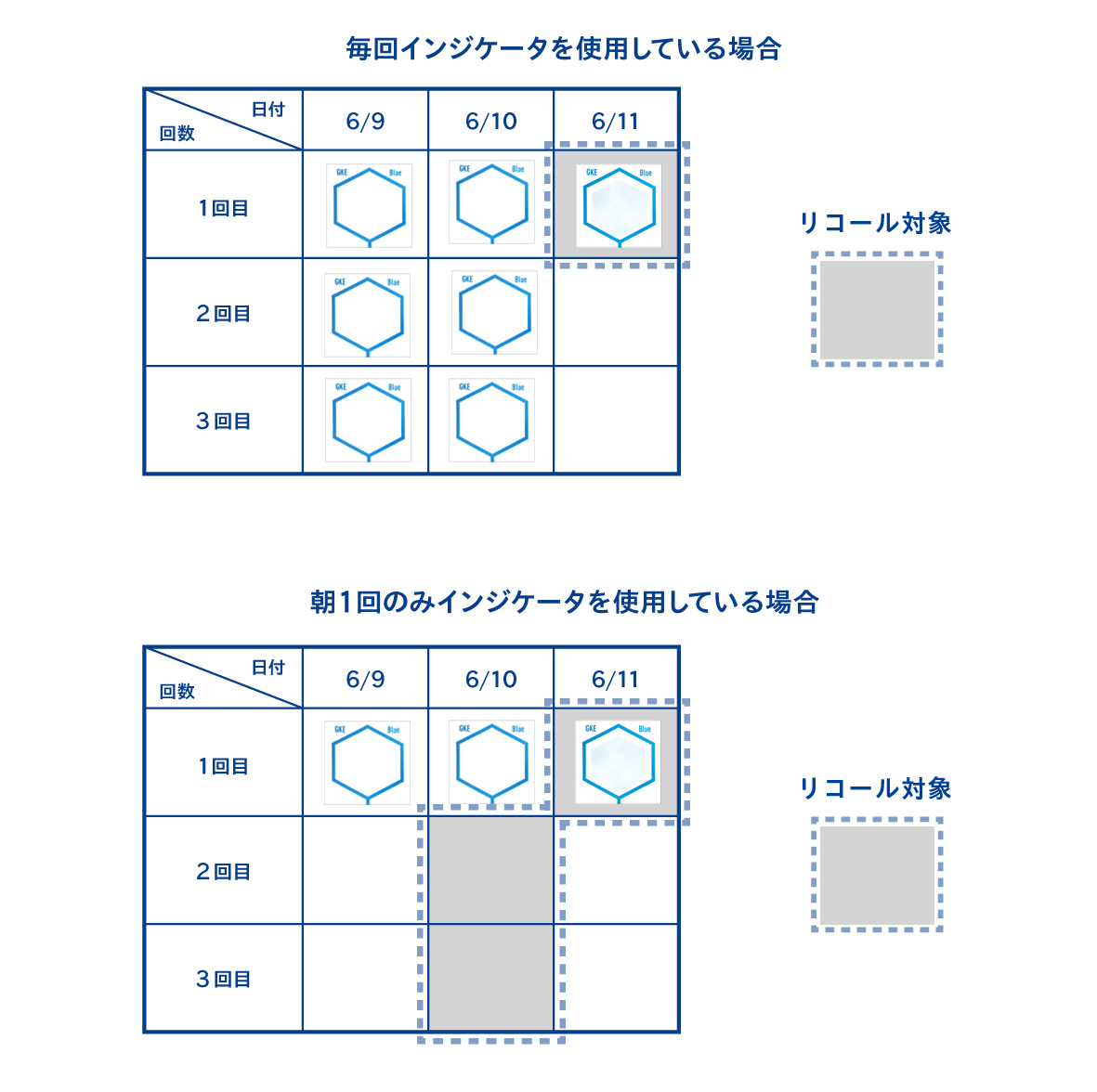
使用している洗浄インジケータが、あらかじめ設定した合格基準を満たしているかを確認します。
洗浄インジケータは、毎回使用することが望ましいです。仮に朝1回しか使用していない場合、洗浄インジケータが不合格を示した際は、その不合格のロットと、そこから遡って最後にインジケータが合格した直後までのすべてのロットがリコールの対象となります。毎回洗浄インジケータを使用していれば、不合格を示したロットのみがリコール対象となるため、回収する器材を最小限に抑えることができます。
また、適切な洗浄インジケータは、使用しているWDの機種やプログラムによって異なります。適切な洗浄インジケータの選択について詳しく知りたい方は、こちらの記事をご覧ください。
記事:【選定試験】洗浄工程インジケータの特長や選び方、使い方をご紹介します。
5-6. RMDの目視確認:RMDに異物が無いかを確認する
WDの運転終了後、洗浄したすべてのRMDに対して、異物が無いかを目視で確認します。
5-7. 日常モニタリングのまとめ
日常モニタリングは、5つの項目で下記内容を確認し、データを記録・保管します。
| 項目 |
タイミング |
確認内容 |
|
| 運転開始時 | 運転開始後 | ||
| 積載形態 | ✔ | ✔ |
PQで設定した積載条件が守られているか、最大積載量以下に収まっているかを確認する。 |
| スプレーアームの回転障害の有無 | ✔ | ✔ |
プレーアームが適切に回転するかを確認する。運転中にRMDが動いてしまいスプレーアームに干渉してしまうこともあるので運転後も確認する。 |
| 運転記録 | ― | ✔ |
プロセス変数がPQで設定した条件を満たしているかを確認する。 |
| 洗浄インジケータ | ― | ✔ | 使用している洗浄インジケータが合格基準を満たしているかを確認する。 洗浄インジケータの使用は毎回が望ましい。 |
| RMDの目視確認 | ― | ✔ | 洗浄したすべてのRMDに対して、異物が無いかを目視で確認する。 |
6. まとめ
いかがでしたでしょうか。
医療器材の再生処理における洗浄工程は、「洗浄なくして滅菌なし」と言われるように、安全な器材を提供するうえでとても重要な工程です。洗浄工程の目指すべきゴールは「残留蛋白質量が200μg/RMD以下であること」ですが、バリデーション+日常モニタリングの考え方でそれを保証します。
バリデーションでは、もっとも洗浄が難しいマスター製品が洗浄できるプログラムであるかを検証し、そのプログラムが確実に実行されているかを日常モニタリングで検証します。
本記事の内容に関するお問合せは、営業担当またはSALWAYウェブサイトのお問合せフォームよりご連絡下さい。








